Due proteine sono state unite stabilmente per la prima volta
Due proteine sono state unite stabilmente per la prima volta
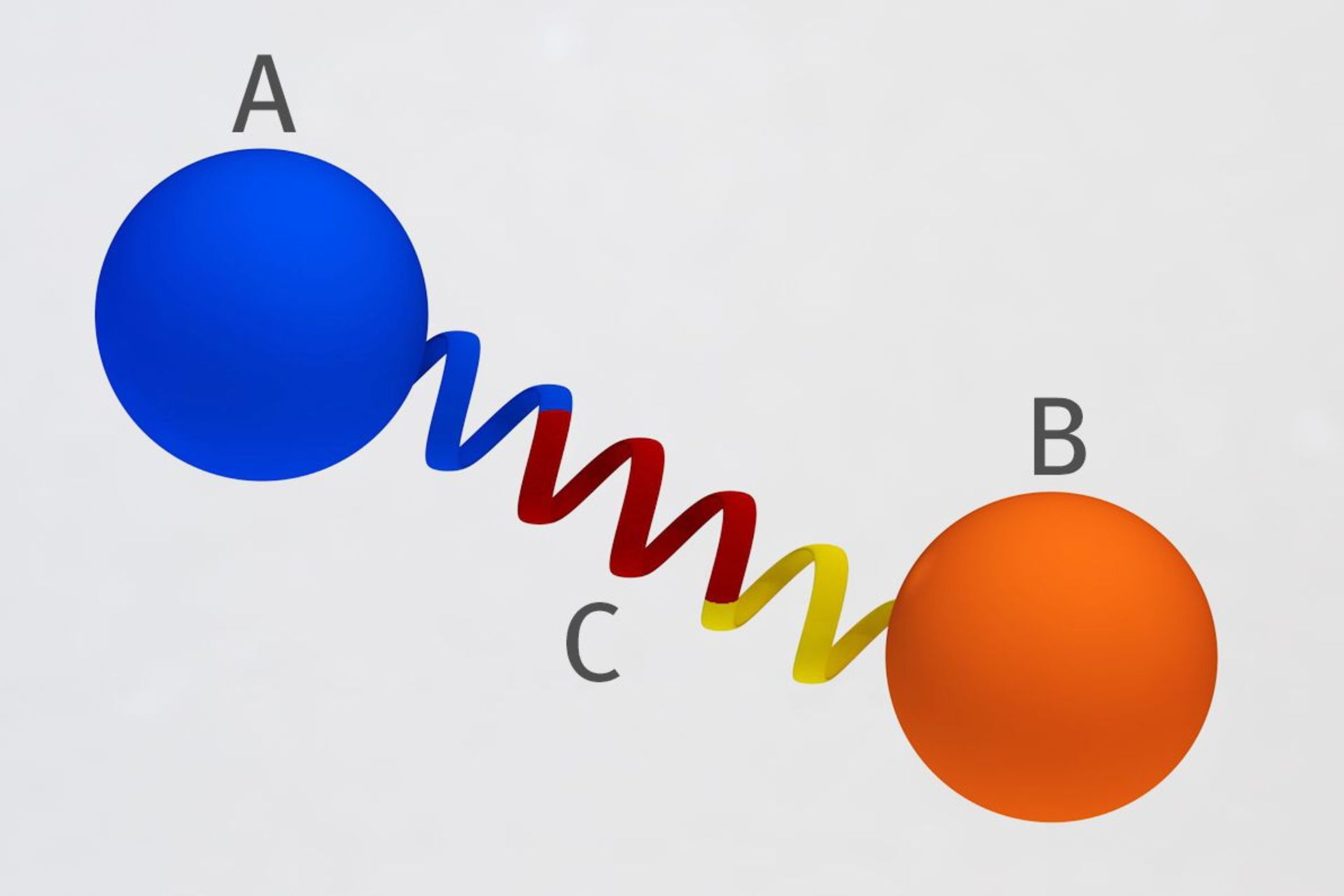
All’Istituto Paul Scherrer è stato costruito un legame proteico a spirale, rigido e indipendente, capace di avere distanze e angoli predefiniti
(Grafica: Mahir Dzambegovic/Istituto Paul Scherrer)
I ricercatori dell’Istituto Paul Scherrer, ente di ricerca appartenente al settore dei Politecnici Federali della Confederazione Elvetica, sono stati i primi ad aver unito due proteine per mezzo di un collegamento rigido e indipendente.
L’elemento strutturale tiene insieme le due molecole proteiche a una distanza e un angolo predefiniti, proprio come la maniglia di un bilanciere collega due pesi.
Questo tipo di collegamento potrebbe aiutare, per esempio, a sviluppare le cosiddette “particelle simili a virus” per ottenere vaccini, tanto più che i ricercatori svizzeri hanno già riportato i loro risultati nella rivista specializzata “Structure”.
L’articolo, uscito online il 28 settembre 2021 all’indirizzo URL https://dx.doi.org/10.1016/j.str.2021.09.002 e firmato da Gabriella Collu, Tobias Bierig, Anna-Sophia Krebs, Sylvain Engilberge, Niveditha Varma, Ramon Guixà-González, Timothy Sharpe, Xavier Deupi, Vincent Olieric, Emiliya Poghosyan e Roger M. Benoit, è intitolato in lingua inglese “Chimeric single α-helical domains as rigid fusion protein connections for protein nanotechnology and structural biology”.
Latte, vitamina D ed osteoporosi: qual è il legame occulto?

“Fin qui difficile imitare in vitro la rigidità proteica naturale”
“Le proteine sono state ottimizzate dal processo di evoluzione nel corso di milioni di anni”, dice il biologo molecolare Roger Benoit del Laboratorio per la Biologia su Scala Nanometrica del PSI.
“In natura, dove le proteine devono essere rigide, lo sono. Ma è difficile imitarle in vitro”.
Se si vuole unire due proteine e mantenerle a una distanza e a un angolo definiti tramite un ponte proteico, l’operazione risulta in genere molto complessa. L’elemento di collegamento di solito risulta essere troppo flessibile, permettendo alle due proteine di avvicinarsi troppo l’una all’altra.
È come se si legassero due pesi con una corda. Non appena si solleva il cordone in modo che i pesi possano oscillare liberamente, essi fatalmente si “toccano”. Quando le molecole di proteine si avvicinano l’una all’altra, però, possono interagire.
I contatti tra le proteine spesso limitano la naturale libertà di movimento della struttura complessiva: le molecole si muovono diversamente da come farebbero se non ci fosse alcun contatto con l’altra proteina.
Ci potrebbero essere molte applicazioni per i legami con minore flessibilità, ma progettarli è difficile.
“Spesso, è difficile prevedere il modo in cui le proteine si piegano e come appare la loro struttura nella realtà”, dice Roger Benoit.
Cioè, mettere in fila diverse proteine con la spaziatura e l’orientamento desiderati di solito richiede un’ottimizzazione estremamente complessa in laboratorio.
Roger Benoit e il suo team hanno ora trovato una soluzione. Hanno usato un segmento di una proteina che gioca un ruolo, per esempio, nella guarigione delle ferite nel corpo umano. Una parte di questa proteina forma un’elica, un elemento a spirale.
La sua spina dorsale è stabilizzata dalle interazioni tra le catene laterali. Così, l’elica rimane intatta da sola ed è abbastanza rigida, quasi come una spirale di metallo in acciaio temperato. Con questo, gli scienziati dell’istituto di ricerca argoviese è riuscito a collegare diverse proteine l’una all’altra nel modo desiderato.
In termini di analogia con un bilanciere, ciò significa che i ricercatori hanno ora legato le proteine insieme usando una spirale di metallo invece di una corda, mantenendo così costante la distanza tra loro. In questo modo, hanno anche impostato l’orientamento delle due proteine l’una rispetto all’altra.
Tiroidite e Gozzo: così nella Bergamasca ci si ammala di più
Il “collegamento proteico” sarà l’input verso nuovi vaccini?
Tali connessioni rigide hanno un notevole potenziale per molte applicazioni pratiche. Tra le altre cose, potrebbero rivelarsi utili nello sviluppo di vaccini contro i virus, tra cui il SARS-CoV-2.
I vaccini sono spesso prodotti rendendo gli agenti patogeni inattivi. Non possono più nuocere agli esseri umani, ma stimolano il sistema immunitario a produrre anticorpi. Le particelle simili ai virus preparate in laboratorio sono un’opzione alternativa.
Molte proteine di superficie caratteristiche di un virus sono attaccate alle parti superiori di queste particelle simili a virus, in modo che il sistema immunitario le rilevi e generi anticorpi.
Un vantaggio offerto dalle particelle simili ai virus è che, poiché esse non contengono materiale genetico dell’agente patogeno, non c’è possibilità che si moltiplichino.
Per questo motivo, sono più sicure degli agenti patogeni indeboliti, e sono attualmente oggetto di studio per la protezione contro diversi virus, come l’epatite B e il papilloma virus del genere umano.
Con il connettore rigido congegnato fra Villigen e Würenlingen, le proteine del virus potrebbero essere attaccate alla superficie di tali particelle simili ai virus in modo più preciso.
La flessibilità limitata dell’elica offre dei vantaggi: “Se la connessione tra la particella e la proteina del virus fosse troppo flessibile, le proteine potrebbero ripiegarsi di nuovo, e allora non sarebbero più accessibili”, spiega Roger Benoit.
Il sistema immunitario non le riconosce altrettanto bene. Se le proteine si distinguono maggiormente dalle particelle e si presentano tutte a un angolo e a una distanza predeterminati, come è possibile con il distanziatore realizzato in Svizzera, si potrebbero sviluppare vaccini migliori e più efficaci.
Il ricercatore elvetico spera che nuovi biomateriali possano essere creati in questo modo. L’elica potrebbe servire come un blocco di costruzione in combinazione con altre proteine.
In Svizzera le avvisaglie dell’Alzheimer rilevate nel sangue
In arrivo impalcature proteiche in 3D per sostituire pezzi d’osso?
In futuro, i ricercatori potrebbero essere in grado di costruire impalcature proteiche in 3D, per esempio, per sostituire un pezzo di osso.
“Oppure si potrebbe usare per combinare le proteine in lunghe stringhe e creare nuovi tessuti simili alla seta, che poi potrebbero anche essere biodegradabili”.
Anche i ricercatori del PSI e degli istituti di ricerca di tutto il mondo che stanno lavorando sulla comprensione strutturale delle proteine potrebbero e, forse, dovrebbero beneficiare del nuovo metodo.
Questo perché le molecole proteiche collegate fra loro tramite l’elica rigida potrebbero essere ottimizzate in modo da ottenere forme di cristallizzazione e, tuttavia, mantenere la loro naturale libertà di movimento nei cristalli. Questo renderebbe più facile esaminare la loro struttura.
Con i nuovi metodi di analisi strutturale dei cristalli di proteine, per esempio, usando il laser a elettroni liberi dello SwissFEL (Switzerland’s X-ray Free-Electron Laser) disponibile presso i laboratori dell’Istituto Paul Scherrer, le proteine possono anche essere osservate in azione, per esempio quando le pompe della membrana trasportano sostanze fuori da una cellula.
Video, arriva l’App elvetica per ridurre lo sperpero di cibo

(Foto: Mahir Dzambegovic/Istituto Paul Scherrer)
Potresti essere interessato anche a:
“Ossigeno oscuro”: l’inedita scoperta sul fondo dell’Oceano
I noduli polimetallici sui fondali del Pacifico producono l'elemento "O": l'eclatante rivelazione solleva ulteriori domande sul deep sea mining
Stati Uniti: Grana Padano protagonista della ristorazione
Il Consorzio di Tutela vola a San Antonio per la prima tappa di una campagna che sensibilizza i consumatori sul tema dell’Italian Sounding
Deep Sea Mining, la corsa all’oro che minaccia le balene
L'allarme degli scienziati: se l’ISA darà il via libera all’estrazione di minerali sui fondali marini ci saranno conseguenze catastrofiche...
Tutta l’innovazione dell’approdo del Gruppo Chery in Europa
Il 4 luglio i brand cinesi Omoda e Jaecoo hanno fatto il loro debutto a Milano e sul nostro mercato con auto sostenibili e al passo dei tempi




