Ossido metallico nei tumori per potenziare la röntgenterapia
Ossido metallico nei tumori per potenziare la röntgenterapia
L’EMPA e il Politecnico di Zurigo hanno sintetizzato tre tipi di nanoparticelle che agiscono da “radiosensibilizzatori” per trattare il cancro
(Foto EMPA/Politecnico Federale di Zurigo)
La radioterapia è una delle pietre miliari nella terapia del cancro. Tuttavia, alcuni tipi di tumore rispondono poco o per nulla alle radiazioni. Se fosse possibile rendere le cellule tumorali più sensibili alle terapie radianti, il trattamento sarebbe più efficace e delicato per il paziente.
I ricercatori dell’EMPA e del Politecnico Federale di Zurigo sono ora riusciti a utilizzare nanoparticelle di ossido di metallo come “radiosensibilizzatori”, e a produrle su scala industriale.
Come prevenire l’Alzheimer con il “drenaggio del cervello”
In un secolo le radiazioni ionizzanti ancora insoddisfacenti per gli oncologi
Oggi sono disponibili diverse metodologie di trattamento del cancro, che possono completarsi a vicenda. La radioterapia è usata frequentemente, e può essere combinata con la chirurgia e la chemioterapia, per esempio.
Anche se il trattamento con radiazioni ionizzanti è usato in medicina da più di 100 anni, l’oncologia moderna a volte non è soddisfatta della sua efficacia.
Il motivo? I tumori maligni non sono sempre abbastanza sensibili alla röntgenterapia. “Se si potesse aumentare la sensibilità delle cellule tumorali, le terapie radianti potrebbero essere effettuate in modo più efficace e più delicato”, dice il ricercatore dell’EMPA Lukas Gerken.
In altre parole, un risultato desiderato dei trattamenti potrebbe essere raggiunto con una dose inferiore di radiazioni rispetto a quella attuale, o i tumori particolarmente resistenti alla röntgenterapia potrebbero finalmente diventare sensibili alle radiazioni.
Il team guidato da Lukas Gerken e Inge Herrmann del Particles-Biology Interactions Laboratory dell’EMPA e del Nanoparticle Systems Engineering Laboratory dell’ETH di Zurigo sta quindi lavorando con gli oncologi dell’Ospedale Cantonale di San Gallo per trovare il modo di sensibilizzare le cellule tumorali alle radiazioni.
I ricercatori hanno messo gli occhi su nanoparticelle fatte di ossidi metallici, che possono agire come cosiddetti “radiosensibilizzatori”.
Il team di ricerca è ora riuscito a produrre questi “radiosensibilizzatori” in grandi quantità e ad analizzare il loro effetto in modo più dettagliato.
Gli studiosi in parola hanno recentemente pubblicato i loro risultati nella rivista “Chemistry of Materials”.
La proteina della visione notturna: base per nuove terapie?

(Foto EMPA/Politecnico Federale di Zurigo)
Il diossido di afnio contro i meccanismi di riparazione dei tessuti “maligni”
Nella ricerca sul cancro, sono in corso studi con varie classi di sostanze per rendere più efficace l’irradiazione dei tumori.
L’esatta maniera in cui funzionano, in modo identico o diverso, le nanoparticelle d’oro o gli ossidi metallici più esotici come il diossido di afnio in questo contesto, non è ancora completamente compreso.
Quello che si sa, però, è che una complessa cascata di reazioni esercita lo stress ossidativo nelle cellule tumorali. In questo modo, i meccanismi di riparazione dei tessuti maligni possono essere sopraffatti.
Affinché le nanoparticelle possano essere rese disponibili per l’uso clinico, è stato necessario superare due ostacoli.
La produzione con i metodi convenzionali della chimica umida rende difficile fabbricarne quantità su scala industriale e mancano analisi comparative sull’efficacia delle diverse sostanze.
Lukas Gerken, ricercatore dei Laboratori Federali Svizzeri per la Scienza e la Tecnologia dei Materiali, è ora riuscito a produrre “radiosensibilizzatori” in ossido di metallo con un metodo che è idealmente adatto alle applicazioni industriali.
Ecco perché la placenta umana è un… bersaglio del COVID-19
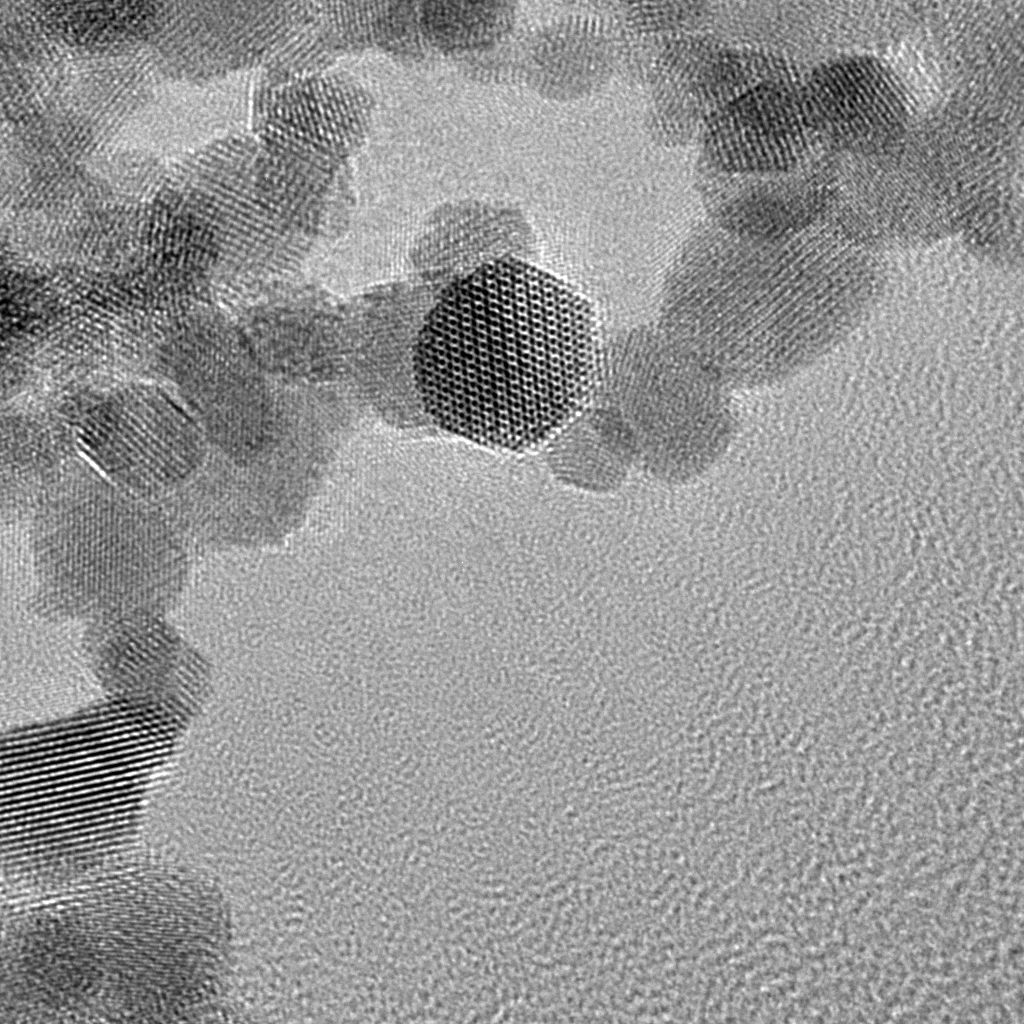
Dalla sintesi alla fiamma, molti kg al giorno di ossidi di zirconio e titanio
Si è affidato alla sintesi alla fiamma per ottenere ossidi di alta qualità di afnio, zirconio e titanio.
“Grazie a questo metodo di produzione, è anche possibile, a seconda dell’impianto di confezionamento, sintetizzarne diversi chilogrammi al giorno”, spiega Gerken.
Per le analisi di laboratorio all’EMPA, tuttavia, lo scienziato si è accontentato di pochi grammi.
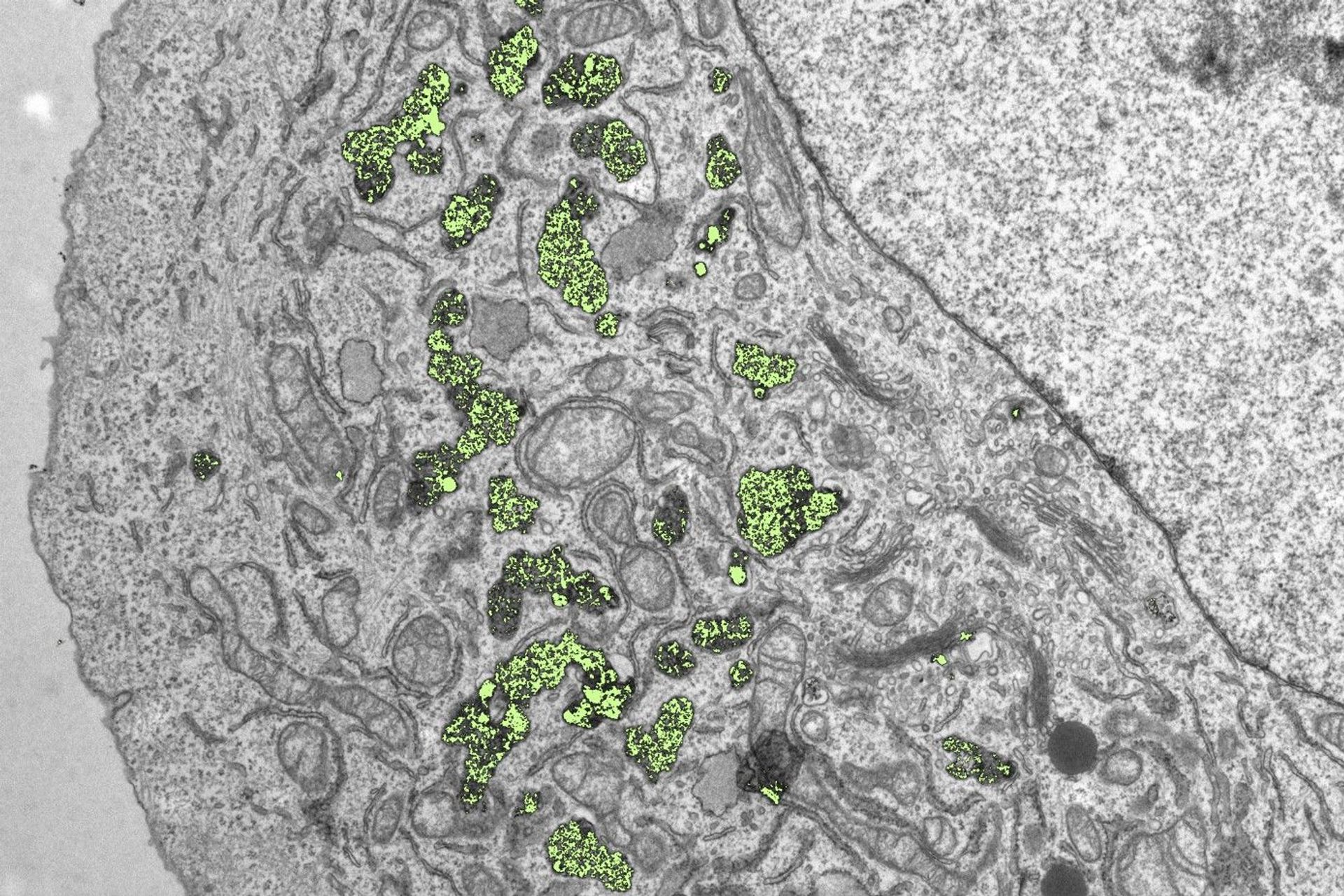
Una volta che le nanoparticelle sono diventate disponibili in quantità adeguate, Lukas Gerken ha potuto esaminare le gemme in dettaglio, ad esempio utilizzando la spettroscopia a raggi X e la microscopia elettronica.
Il verdetto: “Possiamo produrre nanoparticelle di ossido di metallo sterili e di alta qualità che appaiono innocue per le cellule sane”, spiega il ricercatore svizzero.
Lo ha dimostrato usando colture cellulari che ha trattato con diverse sospensioni di nanoparticelle da laboratorio. Gli ossidi metallici si sono accumulati in grandi quantità all’interno dei tessuti umani.
Il primo classificato è stato il diossido di afnio. Qui, mezzo miliardo di nanoparticelle sono entrate in ogni singola cellula senza risultare tossiche per l’organismo umano.
La sindrome del “Colon irritabile” non è faccenda da sintomi

(Foto: EMPA/Politecnico Federale di Zurigo)
Il “nanogold” (od oro colloidale) sicuro, ma quattro volte meno efficace
Rispetto agli ossidi di metallo “povero”, il “nanogold” od oro colloidale ha fatto molto peggio a parità di dimensioni delle particelle: da 10 a 30 volte meno elementi aurei sono entrati nei tessuti.
Per quanto le sostanze siano inizialmente innocue per le cellule sane, esse dispiegano i loro effetti in modo potente quando vengono usate nelle terapie radianti.
Il team svizzero è stato in grado di dimostrarlo, utilizzando linee cellulari di cancro.
Quando le colture sono state trattate con ossidi metallici e poi bombardate con i raggi X, l’uccisione delle neoplasie è aumentata significativamente.
Il diossido di afnio si è rivelato lo strumento più potente. Le cellule tumorali trattate con particelle dell’elemento chimico di numero atomico 72 potevano essere eliminate con meno della metà della dose di radiazioni.
Questo primo studio comparativo ha anche dimostrato che il biossido di afnio è anche quattro volte più efficace del “nanogold” e del biossido di titanio.
Le cellule umane sane (i cosiddetti fibroblasti), d’altro canto, non hanno mostrato effetti negativi o collaterali dalle radiazioni dopo il trattamento con nanoparticelle.
I risultati rendono Lukas Gerken fiducioso: “Continueremo su questa strada per esplorare il meccanismo d’azione delle nanoparticelle e ottimizzare ulteriormente la loro efficienza”.
Egli spera che i suoi studi facciano così progredire l’applicazione clinica di questi ossidi metallici nella radioterapia.
Due proteine sono state unite stabilmente per la prima volta

(Foto: EMPA/Politecnico Federale di Zurigo)
Potresti essere interessato anche a:
Un traguardo per l’innovazione: inaugurato il Park Innovaare
23.000 mq per il futuro a Villigen, accanto all'Istituto Paul Scherrer: l'80 per cento degli spazi sono già affittati a startup, istituti di ricerca…
Come pulire l’aria soffocante di Nuova Delhi: lo studio
Una ricerca sul particolato che asfissia le città dell’India settentrionale rivela quali sono le sostanze particolarmente dannose alla salute
All’Aerodromo militare di Locarno un innovativo rifugio per la fauna
Gli specialisti del DDPS hanno agito sulle siepi perimetrali dello scalo sopracenerino creando un luogo di ritirata e fonte di cibo per gli animali
Una DAO in Formula 1 dall’accordo fra ApeCoin e BWT Alpine
L’organizzazione decentralizzata del teschio roteante e l’équipe francese attiveranno una fanbase mondiale tramite esperienze reali e Web3










